Audiologists and Fitters Alliance(CAFA)
研究进展
来自法国的巴斯德研究所、法国科学研究中心等机构的科学家与迈阿密大学、哥伦比亚大学和旧金山大学合作,设法恢复患有DFNB9听力损失的成年小鼠的听力。
DFNB9 听力障碍是 先天性遗传听 力损失的常 见形式。 由于缺乏编码耳畸蛋白的基因,患有DFNB9听力障碍的人通常是重度听损。
耳畸蛋白在听觉感觉细胞突触传递声音信息时必不可少。 通过给患有DFNB9听损的成年小鼠注射缺乏的这种基因,科学家们成功 将小 鼠的 听觉突触功能和 听觉阈值恢复到接近正常的水平。
这些发现发表在《美国国家科学院院刊》(PNAS)上,为未来对DFNB9患者进行基因治疗试验开辟了新途径。
超过一半的非综合征型听力障碍(一种遗传性听损)病例的成因中,基因问题都占其中一大部分,而且其中大多数(约80%)是由常染色体隐性听力损失(DFNB)引起的。
目前人工耳蜗和助听器是这些患者恢复聆听能力的最佳选择。
海外文献中对于听力障碍原理解释的研究
病毒转移是基因拼接的一种,它使用病毒作为所需基因序列的载体。腺相关病毒(Adeno-associated virus, AAVs)是治疗人类疾病最有前景的基因转移载体之一。
基于腺相关病毒的基因治疗听力损失是一种很有前景的治疗方法,但其应用受到潜在治疗窗狭窄的限制。
对人类来说,内耳的发育在子宫内完成,大约20周的妊娠期后就能听到声音。
海外文献中对于听觉基因原理的说明
此外,一般是在新生儿期进行遗传型先天性听力障碍的诊断。因此,动物模型中的基因治疗方法必须考虑到这一点,当听觉系统已经形成时,基因治疗效果必须在基因注射后得到证明。
换句话说,治疗必须能治好现有的听力损失状况。
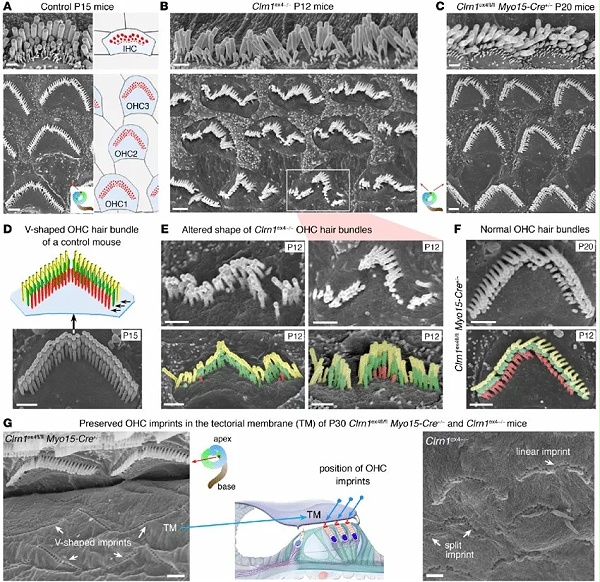
Saaid Safieddine是法国国家科学研究中心(CNRS)听力遗传学和生理学研究所的一名研究人员,他领导了这个研究小组,也是该项目的协调人。他们使用的是患有DFNB9听障的小鼠模型。
海外文献中对于听觉基因治疗的分析
DFNB9听障是由编码耳畸蛋白的基因发生突变引起的。耳畸蛋白在内毛细胞突触传递声音信息方面发挥重要作用。
尽管检测不到小鼠有感觉上皮缺陷,但是由于这些突触在声音刺激下不能释放神经递质,所以缺乏耳畸蛋白的突变小鼠是重度听力损失。
因此,当小鼠的DFNB9听损处于晚期时,它是检测病毒基因治疗效果的合适模型。
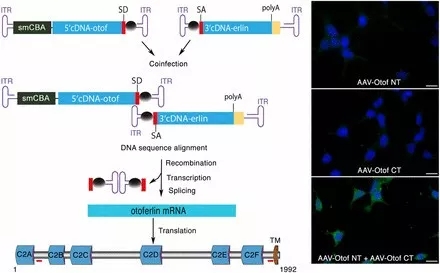
然而,由于腺相关病毒的DNA包装能力有限(DNA包装常指对病毒的核酸核心用蛋白质外壳进行包裹形成成熟的病毒颗粒的过程),只能包装约4.7 个千碱基对,对于编码区域(cDNA)超过5个千碱基对的基因,这一技术将很难施行。而耳畸蛋白的基因编码区域为6个千碱基对。
不过科学家们通过采用一种被称为腺相关病毒双策略的方法克服了这一限制,因为这一方法使用了两个不同的重组质粒,一个包含5'端,另一个包含耳畸蛋白cDNA的3'端。
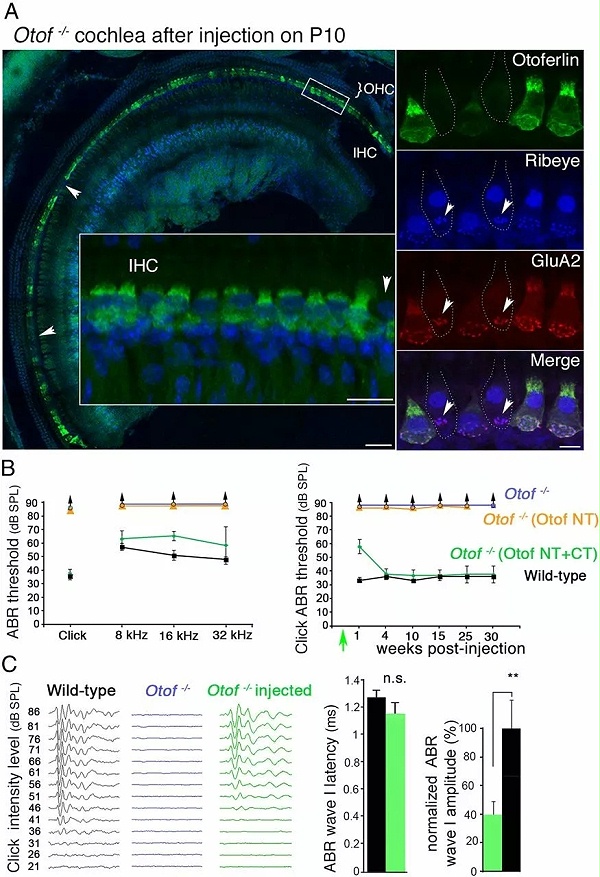
一次将两个重组质粒注射于成年突变小鼠耳蜗内,通过重组DNA5’端和3’端的片段,来重建耳畸蛋白编码区 ,实现长久恢复耳畸蛋白在内毛细胞的表达,进而恢复听力。
因此,科学家们利用两种载体初步验证了cDNA片段在耳蜗内病毒转移的概念,表明该方法可用于产生耳畸蛋白,并可持久纠正小鼠的严重听力障碍。

其他DFNB9研究的文献
科学家的研究结果表明,DFNB9先天性听障患者局部基因转移的治疗窗可能比想象的要宽,同时也为将这些发现扩展到治疗其他类型的听力障碍方面带来了希望。
但这是不是说短期(5~10年内)就有攻克治愈遗传性听力损失的希望了呢?
并不是这样。
通常,动物实验成功后,还要经过伦理审查及人体实验,这个过程十分漫长。为确保安全有效,甚至可能会使用长达数十年时间以观测不良反应。
所以在当下,听损患者积极进行听力干预(助听器人工耳蜗等)才是最佳恢复听力方案。
我们这个时代是一个科学大爆炸的时代,每天都有很多新闻正在发生,所以未来攻克听损难题并非不可实现,只是从目前角度仍然有些遥远。